Топливные элементы для мобильных устройств
Из истории развития батарей и аккумуляторов
Введение
 авайте
задумаемся над тем, что мешает любому мобильному устройству быть по-настоящему
мобильным? Конечно же, ограниченный срок функционирования в автономном режиме,
то есть при работе от аккумуляторной батареи. Время автономной работы зависит
как от средней потребляемой мощности платформы, так и от емкости аккумуляторной
батареи:
авайте
задумаемся над тем, что мешает любому мобильному устройству быть по-настоящему
мобильным? Конечно же, ограниченный срок функционирования в автономном режиме,
то есть при работе от аккумуляторной батареи. Время автономной работы зависит
как от средней потребляемой мощности платформы, так и от емкости аккумуляторной
батареи:
![]()
Увеличить время работы в автономном режиме можно двумя способами: либо уменьшить энергопотребление мобильной платформы, либо увеличить емкость аккумуляторной батареи.
Так, для ноутбуков, для которых время автономной работы является одной из важнейших характеристик, классическим примером того, как за счет уменьшения энергопотребления можно увеличить время автономной работы, является технология Intel Centrino. Новое поколение ноутбуков на базе технологии Intel Centrino способно работать в автономном режиме 5 часов и более (в зависимости от загрузки), потребляя при этом не более 10 Вт. Однако для многих пользователей пяти часов может оказаться недостаточно, поэтому разработчики не останавливаются на достигнутом и пытаются найти комплексный подход к проблеме повышения времени автономной работы.
Как уже отмечалось, кроме снижения энергопотребления, время автономной работы можно повысить за счет увеличения емкости аккумуляторных батарей, однако следует признать, что темпы развития технологий аккумуляторных батарей (особенно в сравнении с темпами развития компьютерной техники) намного медленнее. По большому счету со времени создания первого гальванического элемента никаких кардинальных изменений с аккумуляторными батареями не происходило: основные принципы их функционирования остались прежними, а потому и ожидать в ближайшем будущем сенсаций не приходится.
В то же время нельзя не отметить все возрастающий интерес к аккумуляторным батареям со стороны разработчиков. По мнению ряда экспертов, рынок аккумуляторов для электронных устройств оценивается в 22 млрд. долл., а аналитики из европейской ассоциации EPBA (European Portable Battery Association) полагают, что производство батарей ежегодно удваивается.
Самыми распространенными типами аккумуляторов сегодня являются никель-кадмиевые (NiCd), никель-металлгидридные (NiMH), свинцово-кислотные (Sealed Lead Acid, SLA), литий-ионные (Li-Ion) и литий-полимерные (Li-Polymer). Это так называемые электрохимические источники тока, которые используются в мобильных телефонах, КПК, ноутбуках и т.д. Но, судя по всему, скоро им на смену придет новое поколение топливных элементов питания, которые отличаются значительно большей емкостью на единицу объема. Впрочем, не будем забегать вперед и, прежде чем начать рассмотрение новых топливных элементов, попытаемся разобраться в базовых принципах функционирования гальванических элементов.
Из истории развития батарей и аккумуляторов
 сновные
принципы действия гальванических элементов были открыты еще в конце XVIII века
итальянским физиком Александро Вольта. Как ни странно, все началось с опытов
Луиджи Гальвани, которые он ставил на лягушках. Установлено, что если подвергнуть
мышцы на лапках лягушки воздействию статического электрического заряда, то они
сокращаются. Гальвани также заметил, что мышцы сокращаются, если к ним приложить
два разных металла. Друг Гальвани, Александро Вольта, доказал, что причиной
сокращения мышц лягушки стало электричество, вырабатываемое при соприкосновении
двух различных металлов. Для своих опытов вместо лягушек Вольта использовал
чашу с соляным раствором, погрузив в нее две металлические дуги: одну — медную,
а вторую — цинковую. Так был создан первый гальванический элемент.
сновные
принципы действия гальванических элементов были открыты еще в конце XVIII века
итальянским физиком Александро Вольта. Как ни странно, все началось с опытов
Луиджи Гальвани, которые он ставил на лягушках. Установлено, что если подвергнуть
мышцы на лапках лягушки воздействию статического электрического заряда, то они
сокращаются. Гальвани также заметил, что мышцы сокращаются, если к ним приложить
два разных металла. Друг Гальвани, Александро Вольта, доказал, что причиной
сокращения мышц лягушки стало электричество, вырабатываемое при соприкосновении
двух различных металлов. Для своих опытов вместо лягушек Вольта использовал
чашу с соляным раствором, погрузив в нее две металлические дуги: одну — медную,
а вторую — цинковую. Так был создан первый гальванический элемент.
К 1800 году Вольта усовершенствовал устройство батареи: он применил 20 пар кружочков, изготовленных из двух различных металлов и проложенных кусочками кожи или ткани, которые были смочены в соляном растворе. В результате получилась так называемая гальваническая батарея (знаменитый «вольтов столб»), вырабатывающая электрический ток.
Достижения Вольта послужили основой для дальнейших экспериментов по созданию новых элементов питания.
В 1802 году доктор Уильям Круикшанк разработал первую электрическую батарею на основе цинковых и медных элементов, а в 1836 году английский химик Джон Ф. Даниелл поместил медные и цинковые электроды в емкость с серной кислотой. Эта батарея получила название «элемент Даниелла».
Немецкий химик Роберт Вильгельм Бунзен доработал в 1841 году элемент Гроува, заменив дорогой платиновый электрод дешевым угольным.
В 1859 году француз Гастон Плантэ провел опыт, похожий на тот, что проделал в свое время Вольта. В гальваническом элементе Плантэ в качестве электродов использовались свинцовые пластины, а электролитом являлась разбавленная серная кислота. Плантэ подключил к элементам источник постоянного тока и некоторое время заряжал батарею. После этого прибор сам вырабатывал электричество, выдавая почти всю энергию, потраченную на зарядку. Причем подзаряжать его можно было многократно. Таким образом был изобретен первый свинцовый перезаряжаемый аккумулятор.
Следующим важным достижением было создание в 1866 году элементов Лекланше, которые послужили прототипами для современных сухих батарей. Лекланше использовал катоды из диоксида марганца, смешанного с углем, и цинковые аноды в форме стержня. В качестве электролита применялся раствор нашатыря.
В 1899 году Вальдмар Юнгнер из Швеции изобрел никель-кадмиевый аккумулятор, в котором в качестве положительного электрода был использован диоксид никеля, а в качестве отрицательного — кадмий. Двумя годами позже американский изобретатель Томас Эдисон предложил альтернативную конструкцию, заменив кадмий железом.
Как видим, батареи и аккумуляторы претерпели немало изменений, прежде чем приобрели тот вид, к которому мы привыкли. Конечно, гальванические элементы продолжали совершенствоваться и в XX веке. Так, в 1932 году появился спрессованный анод, а в 1947-м был изобретен никель-кадмиевый полностью герметичный аккумулятор.
После краткого экскурса в историю развития батарей и аккумуляторов давайте рассмотрим основные принципы действия этих устройств.
Принцип действия аккумулятора
 юбой
гальванический элемент, будь то батарея или аккумулятор, — это устройство, в
котором электрохимическая энергия, выделяющаяся в результате окислительно-восстановительных
реакций, превращается в электрическую энергию. Процессы, протекающие в гальванических
элементах, очень напоминают электролиз. Однако если в электролизе требуется
внешний источник постоянного тока, позволяющий осуществлять окислительно-восстановительные
реакции на электродах, то для создания гальванических элементов подбирают такие
электроды и электролиты, которые обладают электрохимической энергией, достаточной
для самопроизвольного протекания окислительного и восстановительного процессов.
В этом смысле гальванический элемент — это электролиз наоборот. Рассмотрим принцип
действия простейшего гальванического элемента на основе медного и железного
электродов.
юбой
гальванический элемент, будь то батарея или аккумулятор, — это устройство, в
котором электрохимическая энергия, выделяющаяся в результате окислительно-восстановительных
реакций, превращается в электрическую энергию. Процессы, протекающие в гальванических
элементах, очень напоминают электролиз. Однако если в электролизе требуется
внешний источник постоянного тока, позволяющий осуществлять окислительно-восстановительные
реакции на электродах, то для создания гальванических элементов подбирают такие
электроды и электролиты, которые обладают электрохимической энергией, достаточной
для самопроизвольного протекания окислительного и восстановительного процессов.
В этом смысле гальванический элемент — это электролиз наоборот. Рассмотрим принцип
действия простейшего гальванического элемента на основе медного и железного
электродов.
Если погрузить кусок железа в раствор сульфата меди, то через некоторое время поверхность железа покроется тонкой пленкой меди. Это объясняется тем, что на поверхности железа происходит окислительно-восстановительная реакция:
![]()
В ходе этой реакции ионы меди, присутствующие в растворе сульфата меди, отдают электроны, в результате чего медь восстанавливается, а железо окисляется. Если теперь физически разделить реакции окисления и восстановления, погрузив железо в один сосуд с раствором какой-либо соли двухвалентного железа, а раствор сульфата меди — в другой сосуд, и соединить эти два сосуда (два полуэлемента) «соляным мостиком», а электроды — металлическим проводником, то получится простейший гальванический элемент (рис. 1).
В нем, как и прежде, происходят процессы окисления железа ![]() и
восстановления меди
и
восстановления меди ![]() , однако теперь
они физически разделены, а обмен электронами осуществляется по внешней цепи,
то есть именно по ней проходит электрический ток. Отметим, что железный электрод
погружают непосредственно в раствор электролита, а в раствор сульфата меди —
какой-либо инертный электрод, например угольный стержень, чтобы осуществить
электрический контакт с раствором. Соляной мостик, разделяющий сосуды, представляет
собой электрический проводник, по которому катионы и анионы перемещаются от
одного полуэлемента к другому.
, однако теперь
они физически разделены, а обмен электронами осуществляется по внешней цепи,
то есть именно по ней проходит электрический ток. Отметим, что железный электрод
погружают непосредственно в раствор электролита, а в раствор сульфата меди —
какой-либо инертный электрод, например угольный стержень, чтобы осуществить
электрический контакт с раствором. Соляной мостик, разделяющий сосуды, представляет
собой электрический проводник, по которому катионы и анионы перемещаются от
одного полуэлемента к другому.
В уже упоминавшемся сухом элементе Лекланше используются цинковый сосуд, выполняющий функцию анода, и угольный инертный катод, погружаемый в него. Электролит содержит измельченный оксид марганца (MnO2), а также хлорид аммония (NH4Сl). При этом на аноде происходит реакция окисления цинка:
![]()
а на катоде — восстановительная реакция:
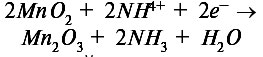
Выделяющийся на катоде аммиак образует с ионами цинка, возникающими на аноде, комплексный ион Zn(NH2)42+, и гальванический элемент может действовать до тех пор, пока не израсходуется один из реагентов. По этой причине сухой элемент невозможно регенерировать, или перезарядить, из-за чего его и называют первичным элементом.
Особый интерес представляют вторичные гальванические элементы, или аккумуляторы. Они основаны на обратимых электрохимических реакциях, в результате чего их можно регенерировать, или перезаряжать. Наиболее известным элементом подобного типа является свинцовый аккумулятор. На аноде этого элемента происходит окислительная реакция:
![]()
а на катоде восстановительная реакция:
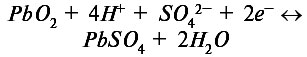
Электролитом в свинцовом аккумуляторе является серная кислота. При работе свинцового аккумулятора на каждом из электродов образуется сульфат свинца, что понижает концентрацию серной кислоты. После перезарядки свинцового аккумулятора концентрация серной кислоты восстанавливается.
В элементе Эдисона используются железный анод и катод из диоксида никеля, погруженные в щелочные электролиты. При этом реакции на электродах описываются уравнениями:
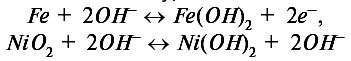
Никель-железный аккумулятор значительно легче свинцового и может храниться не разрушаясь.
Количество уже созданных аккумуляторов, различающихся материалами электродов и электролитами, достаточно велико: никель-кадмиевые, никель-металлгидридные, литий-ионные, литий-полимерные и др.
В настоящее время для мобильных устройств применяются в основном литий-ионные аккумуляторы. Литий является самым химически активным металлом, благодаря чему батареи получаются не только очень емкими, но и имеют самое высокое номинальное напряжение. В зависимости от анода литийсодержащие элементы имеют выходное напряжение от 1,5 до 3,6 В.
Однако активность лития таит в себе опасность. Известно, что литий может воспламеняться на воздухе. По этой причине элементы на основе металлического лития практически не используются, а металлический литий заменен на ионы лития.
В литий-ионных элементах ионы лития связаны молекулами других веществ. Типичный Li-Ion-аккумулятор имеет угольный анод и катод из литий-кобальтдиоксида. Электролит основан на растворе солей лития.
Топливные аккумуляторы
 последнее время ведется активная работа над созданием так называемых топливных
элементов питания, то есть электрохимических элементов, требующих в процессе
работы постоянного расходования электродного вещества. Собственно, идея топливных
элементов не нова — попытки создания таких источников предпринимались уже неоднократно.
Теория топливных элементов была разработана еще в 1839 году английским ученым
Вильямом Гроувом, а в 60-х годах ХХ века НАСА начало использовать топливные
элементы в космосе. В настоящее время активно разрабатываются топливные элементы
питания для мобильных устройств (например, для ноутбуков). По прогнозам специалистов,
ноутбук с топливным аккумулятором сможет работать до 20 часов без подзарядки,
а для того, чтобы зарядить аккумулятор, потребуется лишь элемент с жидким топливом
(метанолом).
последнее время ведется активная работа над созданием так называемых топливных
элементов питания, то есть электрохимических элементов, требующих в процессе
работы постоянного расходования электродного вещества. Собственно, идея топливных
элементов не нова — попытки создания таких источников предпринимались уже неоднократно.
Теория топливных элементов была разработана еще в 1839 году английским ученым
Вильямом Гроувом, а в 60-х годах ХХ века НАСА начало использовать топливные
элементы в космосе. В настоящее время активно разрабатываются топливные элементы
питания для мобильных устройств (например, для ноутбуков). По прогнозам специалистов,
ноутбук с топливным аккумулятором сможет работать до 20 часов без подзарядки,
а для того, чтобы зарядить аккумулятор, потребуется лишь элемент с жидким топливом
(метанолом).
Рассмотрим принцип действия топливного аккумулятора на простейшем примере элемента на кислороде и водороде (рис. 2). В таком элементе происходит поглощение водорода и кислорода в присутствии щелочного раствора. Кислород и водород поступают в элемент сквозь пористые угольные электроды, а электродные реакции описываются уравнениями:
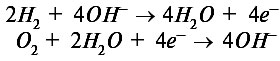
Таким образом, в результате окислительно-восстановительных необратимых реакций образуется вода.
Как видно из приведенных реакций, в основе топливных элементов лежит простая реакция окисления-восстановления, но происходит она не на электродах, а в топливе. Масса электродов в процессе работы никогда не меняется, а топливо служит в качестве источника свободных электронов.
В подобных топливных элементах могут использоваться различные типы топлива. В качестве окисляемых на аноде веществ вместо водорода можно применять углеводороды (например, метанол).
В отличие от традиционных аккумуляторов, топливный элемент не изнашивается и служит до тех пор, пока не израсходуется все топливо, после чего для дальнейшей работы требуется лишь новая порция топлива.
Самой перспективной технологией топливных элементов в настоящее время является технология топливных батарей на метаноле (Direct Methanol Fuel Cell, DMFC). В таких топливных элементах топливом является метиловый спирт, или метанол (CH3OH). На аноде топливного элемента, выполненного из пластинчатого углерода, происходит реакция окисления метанола, в результате которой образуются электроны, необходимые для создания постоянного тока. Побочными продуктами реакции окисления являются углекислый газ и протоны (H+):
![]()
На катоде из пластинчатого углерода происходит реакция восстановления кислорода, поступающего из воздуха, в результате которой образуется вода:
![]()
В DMFC-топливном элементе окислительная и восстановительная реакции физически разделены с помощью ионной полимерной мембраны (Polymer Electrolyte Membrane, PEM), пропускающей протоны от анода к катоду. Структурная схема DMFC-топливного элемента показана на рис. 3.
Как видно из приведенных окислительно-восстановительных реакций, в метаноловом топливном элементе метанол разлагается на углекислый газ и воду:
![]()
Побочные продукты необходимо выводить из системы, постоянно контролируя подачу топлива (метанола и кислорода) в DMFC-ячейку. Кроме того, необходимо отводить образующееся в результате реакции тепло. Поэтому типичная схема DMFC-элемента содержит несколько субкомпонентов, таких как картридж с топливом, датчик метанола, насос для обеспечения циркуляции топлива, воздушный насос, теплообменник и т.д. Типичная система DMFC-элемента показана на рис. 4.
В заключение отметим, что прототипы будущих топливных элементов для различных мобильных платформ уже созданы (рис. 5). Более того, по прогнозам аналитиков, после выхода первых устройств в 2004-2005 годах объем рынка топливных элементов питания быстро превысит миллиард долларов (рис. 6).
В статье использованы материалы московского форума IFD Fall 2003 корпорации Intel.








